Reacció de Koch
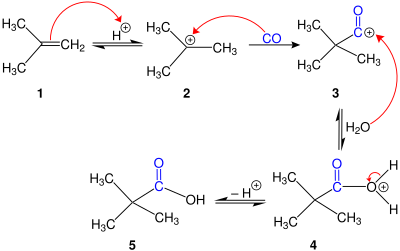
La reacció de Koch és una reacció orgànica per a la síntesi d'àcids carboxílics terciaris a partir d'alcohols o alquens. La reacció és una carbonilació fortament catalitzada per àcids utilitzant monòxid de carboni, i normalment es produeix a altes pressions que oscil·len entre 50 i 5.000 k Pa, sovint requereixen temperatures uns centenars de graus superiors a la temperatura ambient. Generalment la reacció es realitza amb àcids minerals forts com l'àcid sulfúric, HF o BF ₃.[1]
Mecanisme
Quan s'utilitzen catalitzadors àcids estàndard com l'àcid sulfúric o una barreja de BF ₃ i HF, el mecanisme [2] comença per la protonació de l'alcè, seguida de l'atac de monòxid de carboni del carbocatió resultant. El catió acili posterior s'hidrolitza a l'àcid carboxílic terciari. Si el substrat és un alcohol, es protona i, posteriorment, s'elimina, generant un carbocatió que es converteix en catió acili pel monòxid de carboni i després s'hidrolitza. La formació de carbocatió terciari és típicament afavorida termodinàmicament quan es consideren els desplaçaments d'hidrur o alquil en el carbocatió.
Les operacions a gran escala per a la indústria química fina produeixen gairebé 150.000 tones d'àcids de Koch i els seus derivats anualment [3] però també generen una gran quantitat de residus, la qual cosa motiva els intents en curs d'utilitzar metalls, àcids sòlids i altres catalitzadors nous per permetre l'ús de condicions de reacció més suaus. L'àcid fòrmic, que es descompon fàcilment en monòxid de carboni en presència d'àcids o de calor relativament baix, s'utilitza sovint en lloc del monòxid de carboni directament; aquest procediment es va desenvolupar poc després de la reacció de Koch i s'anomena més comunament la reacció de Koch-Haaf. Aquesta variació permet reaccions a temperatura i pressió ambient gairebé estàndard. Alguns àcids de producció industrial Koch habitual inclouen l'àcid pivàlic, l'àcid 2,2-dimetilbutíric i l'àcid 2,2-dimetilpentanoic.

Ús i variacions del catalitzador
L'aplicació industrial a gran escala de la reacció de Koch amb àcids minerals forts es complica per la corrosió dels equips, els procediments de separació dels productes i la dificultat per gestionar grans quantitats d'àcids residuals. S'han investigat diverses resines àcides [4][5] i líquids iònics àcids [6] per tal de descobrir si els àcids de Koch es poden sintetitzar en entorns més suaus. Tot i que l'ús de líquids iònics àcids per a la reacció de Koch requereix temperatures i pressions relativament altes (8 MPa i 430 K en un estudi de 2006 [6]), les solucions iòniques àcides en si es poden reutilitzar amb només una lleugera disminució del rendiment, i el les reaccions es poden dur a terme de forma bifàsica per garantir una fàcil separació dels productes. També s'ha investigat un gran nombre de catalitzadors de catalitzadors de metalls de transició per utilitzar-los en reaccions semblants a Koch: catalitzadors de cations de carbonil Cu(I),[7] Au(I) [8] i Pd(I) [9] carbonil dissolts en sulfúric. l'àcid pot permetre que la reacció progressi a temperatura ambient i pressió atmosfèrica. L'ús d'un catalitzador de tetracarbonil de níquel amb CO i aigua com a nucleòfil es coneix com a carbonilació de Reppe, i hi ha moltes variacions d'aquest tipus de carbonilació mediada per metalls utilitzats a la indústria, especialment els utilitzats per Monsanto i els processos Cativa, que converteixen metanol. a àcid acètic utilitzant catalitzadors àcids i monòxid de carboni en presència de catalitzadors metàl·lics.
Productes secundaris
Les reaccions de Koch poden implicar un gran nombre de productes secundaris, tot i que generalment són possibles rendiments elevats (Koch i Haaf van informar de rendiments superiors al 80% per a diversos alcohols al seu article de 1958). S'observen reordenaments de carbocations, eterització (en cas que s'utilitzi un alcohol com a substrat, en lloc d'un alquè) i, ocasionalment, els àcids carboxílics C N+1 del substrat s'observen a causa de la fragmentació i dimerització dels ions carbeni derivats del monòxid de carboni, sobretot perquè cada pas de la reacció és reversible.[10] També se sap que els àcids alquilsulfúrics són possibles productes secundaris, però normalment s'eliminen per l'excés d'àcid sulfúric utilitzat.
Aplicacions
Les reaccions de tipus Koch-Haaf veuen un ús extensiu en el disseny racional de fàrmacs [11][12] com una manera convenient de generar àcids carboxílics terciaris crucials. Empreses com Shell i ExxonMobil produeixen àcid pivàlic a partir d'isobutè mitjançant la reacció de Koch,[3] així com diversos altres àcids carboxílics ramificats. Tanmateix, les reaccions de Koch-Haaf també s'utilitzen per a l'interrogació de diversos altres temes. Com que els reactius es troben en diferents fases, la reacció de Koch s'ha utilitzat per estudiar la cinètica de reaccions dels sistemes gas-líquid-líquid,[13] així com per consultar l'ús de resines àcides sòlides i líquids iònics àcids per reduir els residus de subproductes perillosos.
Referències
- ↑ Koch, H.; Haaf, W. Ann. 1958, "618", 251–266.(doi:10.1002/jlac.19586180127)
- ↑ Li, J. J. In "Koch–Haaf carbonylation"; Name Reactions, 4th ed.; Springer, Berlin, 2009; p. 319. (doi:10.1007/978-3-642-01053-8_140)
- ↑ 3,0 3,1 Weissermel, K., Jargen-Arpe, H. In "Syntheses involving carbon monoxide", Industrial Organic Chemistry; VCH Publishers: New York, NY; pp. 141–145. (ISBN 978-3527320028)
- ↑ Tsumori, N., Xu, Q., Souma, Y., Mori, H. J. Mol. Cat. A, 2002, 179, 271–77. (doi:10.1016/S1381-1169(01)00396-X)
- ↑ Xu, Q., Inoue, S., Tsumori, N., Mori, H., Kameda, M., Fujiwara, M., Souma, Y. J. Mol. Cat. A, 2001, 170, 147. (doi:10.1016/S1381-1169(01)00054-1)
- ↑ 6,0 6,1 Qiao, K., Yokoyama, C. Cat. Comm. 2006, 7, 450–453. (doi:10.1016/j.catcom.2005.12.009)
- ↑ Souma, Y. Sano, H., Iyoda, J. J. Org. Chem., 1973, 38, 2016. (doi:10.1021/jo00951a010)
- ↑ Xu, Q., Imamura, Y., Fujiwara, M., Souma, Y. J. Org. Chem., 1997, 62, 1594–1598. (doi:10.1021/jo9620122)
- ↑ Xu, Q., Souma, Y. Top. Catal., 1998, 6, 17. (doi:10.1023/A:1019158221240)
- ↑ Stepanov, A. G., Luzgin, M. V., Romannikov, V. N., Zamaraev, K. I. J. Am. Chem. Soc., 1995, 117, 3615–16. (doi:10.1021/ja00117a032)
- ↑ Barton, V., Ward, S. A., Chadwick, J., Hill, A., O'Neill, P. M. J. Med. Chem., 2010, 53, 4555–59. (doi:10.1021/jm100201j)
- ↑ Brilman, D. W. F., van Swaaij, W. P. M., Versteeg, G. F. Chem. Eng. Sci., 1999, 54, 4801–09. (doi:10.1016/S0009-2509(99)00197-9)
- ↑ Becker, C. L., Engstrom, K. M., Kerdesky, F. A., Tolle, J. C., Wagaw, S. H., Wang, W. Org. Process Res. Dev., 2008, 12, 1114–18. (doi:10.1021/op800065q)