Agrégation de particules
L'agrégation (ou agglomération) de particules fait référence à la formation d'assemblages dans une suspension et représente un mécanisme conduisant à la déstabilisation fonctionnelle d'un système colloïdal. Au cours du processus, les particules dispersées dans une phase liquide se collent les unes aux autres et forment spontanément des assemblages de particules irréguliers, que l'on nomme des « agglomérats », ou des « flocs ». Ce phénomène est également appelé coagulation ou floculation et une telle suspension est dite « instable ». L'agglomération des particules peut être induite par l'ajout de sels ou d'autres produits chimiques appelés coagulant ou floculant[1].

L'agglomération des particules est un processus qui peut être réversible ou irréversible. Les agglomérats de particules définis comme « agglomérats durs » sont plus difficiles à disperser en particules individuelles. Au cours de l'agglomération, les agglomérats augmentent en taille et peuvent par conséquent se déposer au fond du récipient, ce que l'on appelle la sédimentation. Alternativement, un gel colloïdal peut se former dans les suspensions les plus concentrées, ce qui modifie les propriétés rhéologiques. Le processus inverse, par lequel les agglomérats de particules sont dispersés pour redonner des particules individuelles, s'appelle la peptisation. Il ne se produit que très rarement spontanément, mais peut se produire par agitation ou sous des contraintes de cisaillement.
Des particules colloïdales peuvent rester dispersées dans un liquide pendant de longues périodes (de quelques jours à plusieurs années). Ce phénomène est appelé « stabilité colloïdale » et la suspension est dite fonctionnellement « stable ». Les suspensions stables sont souvent obtenues avec des concentrations faibles, ou encore par ajout de produits chimiques stabilisants. La stabilité des particules, qu'elles soient colloïdales ou non, est le plus souvent évaluée par le potentiel zêta. Ce paramètre fournit une mesure facilement quantifiable de la répulsion entre les particules, qui est le principal inhibiteur de l'agrégation.
Des processus d’agglomération similaires se produisent également dans d’autres systèmes dispersés. Dans le cas des émulsions, ils peuvent également être couplées à la coalescence des gouttelettes, et conduire non seulement à une sédimentation mais également à un crémage. Concernant les aérosols, les particules en suspension dans l'air peuvent également s'agréger et former des amas plus gros (comme dans le cas de la suie, issue de particules de quelques dizaines de nanomètres formées à partir de HAP[2]).
Étapes préliminaires
Une suspension colloïdale bien dispersée est constituée de particules individuelles séparées, et sa stabilité est assurée par des forces répulsives entre ces particules. Lorsque les forces répulsives s’affaiblissent ou deviennent attractives grâce à l’ajout d’un coagulant, les particules commencent à s’agglomérer. Initialement, des doublets de particules A2 se forment à partir de singulets A1 selon le schéma suivant[3] :
Au début du processus d’agrégation, la suspension se compose principalement de particules individuelles. L'ampleur du processus est caractérisée par le coefficient du taux d'agrégation k. Puisque la formation de doublets est un processus du second ordre, les unités de ces coefficients sont m3s−1, car les concentrations de particules sont exprimées en nombre de particules par unité de volume (m−3). Étant donné que les taux d'agrégation absolus sont difficiles à mesurer, on fait souvent référence au rapport de stabilité W, une quantité sans dimension définie par :où kfast est le coefficient du taux d'agrégation dans le régime rapide, et k est le coefficient dans les conditions considérées. Le rapport de stabilité est proche de l'unité en régime rapide. Il augmente en régime lent et devient très important lorsque la suspension est stable.
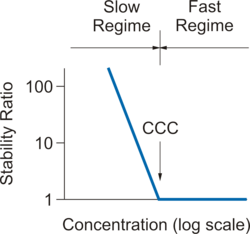
Souvent, les particules colloïdales sont en suspension dans de l'eau. Dans ce cas, elles accumulent une charge de surface et une double couche électrique se forme autour de chacune des particules[4]. Lorsque deux particules se rapprochent l'une de l'autre, le chevauchement entre les double couches diffuses produit un potentiel répulsif que l'on appelle interaction à double couche et qui conduit à la stabilisation des particules. Lorsque du sel est ajouté à la suspension, il fait écran à la répulsion électrique à double couche. L'interaction de Van der Waals devient alors dominante, ce qui permet une agrégation rapide. La figure de droite montre la dépendance typique du rapport de stabilité W par rapport à la concentration d'électrolyte, indiquant les régimes d'agrégation lente et rapide.
Le tableau ci-dessous résume les plages de concentrations de coagulation critiques (CCC) pour différentes charges du contre-ion[5]. La charge est exprimée en nombre de charges élémentaires. Cette dépendance reflète la règle de Schulze-Hardy[6],[7] qui stipule que le CCC varie comme l'inverse de la sixième puissance de la charge du contre-ion. Le CCC dépend d'une moindre mesure du type d’ion, même lorsqu'ils portent la même charge. Cette dépendance peut refléter différentes propriétés des particules ou différentes affinités ioniques avec la surface des particules. Étant donné que les particules sont souvent chargées négativement, les cations métalliques multivalents représentent des coagulants efficaces.
| Charge | CCC ( × 10 −3 mol/L) |
|---|---|
| 1 | 50-300 |
| 2 | 2-30 |
| 3 | 0,03-0,5 |
L'adsorption d'espèces de charge opposée (par exemple, des protons, des ions spécifiquement adsorbants, des tensioactifs ou des polyélectrolytes) peut soit déstabiliser une suspension de particules par neutralisation de charge, soit la stabiliser par accumulation de charge, conduisant à une agrégation rapide près du point de neutralisation de charge et à une agrégation lente lorsque l'on s'éloigne de ce point.
Une interprétation quantitative de la stabilité colloïdale a été formulée pour la première fois dans le cadre de la théorie DLVO[3]. Cette théorie a confirmé l'existence de régimes d'agrégation lent et rapide, même si en régime lent, la dépendance à la concentration en sel est souvent prédite comme étant beaucoup plus élevée que celle que l'on observe expérimentalement. La règle de Schulze-Hardy peut également être dérivée à partir de la théorie DLVO.
D'autres mécanismes de stabilisation colloïdale sont également possibles. En particulier, certains impliquent des polymères qui, lorsqu'ils sont adsorbés ou greffés, peuvent former une couche protectrice autour des particules, induire des forces de répulsion stériques et conduire à une stabilisation stérique. C'est le cas, par exemple, pour l'éther polycarboxylate (en anglais : polycarboxylate ether, ou PCE), la dernière génération de superplastifiant chimiquement adapté et spécifiquement conçu pour augmenter la facilité de mise en œuvre du béton, tout en réduisant sa teneur en eau pour améliorer ses propriétés et sa durabilité. Lorsque les chaînes de polymères sont faiblement adsorbées sur les particules, une chaîne de polymère peut relier deux particules et induire des forces de pontage. Cette situation est appelée floculation par pontage.
Lorsque l’agrégation des particules est uniquement motivée par la diffusion, on parle d’agrégation péricinétique. L'agrégation peut être améliorée par une contrainte de cisaillement, que l'on peut induire par agitation. Ce dernier cas est appelé agrégation orthocinétique.
Étapes ultérieures
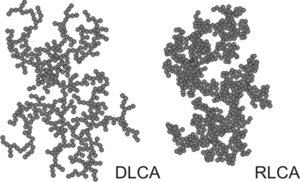
À mesure que le processus d’agrégation se poursuit, des amas de particules plus grands se forment. La croissance se produit principalement par le biais de rencontres entre plusieurs amas plus petits, et on parle donc de processus d'agrégation amas-amas. Les amas résultants sont irréguliers, mais statistiquement auto-similaires. Ce sont des exemples de fractales de masse, pour lesquelles la masse M croît avec la taille typique, cette dernière étant caractérisée par le rayon de giration Rg en suivant une loi de la forme[3] :
où d est la dimension fractale de la masse. Selon que l'agrégation est rapide ou lente, on parle d'agrégation de clusters limitée par diffusion (en anglais : diffusion limited cluster aggregation, ou DLCA) ou d'agrégation de clusters limitée par réaction (en anglais : reaction limited cluster aggregation ou RLCA). Les clusters ont des caractéristiques différentes dans chaque régime. Les clusters DLCA sont lâches et ramifiés (d ≈ 1,8), tandis que les clusters RLCA sont plus compacts (d ≈ 2,1)[8]. La distribution de la taille des clusters est également différente dans ces deux régimes. Les clusters DLCA sont relativement monodispersés, tandis que la distribution de la taille des clusters RLCA est très large.
Plus la taille des amas est grande, plus leur vitesse de sédimentation est rapide. Par conséquent, les particules agrégées se sédimentent, et ce mécanisme permet de les séparer de la suspension dans laquelle elles se trouvent. À des concentrations de particules plus élevées, les amas en cours de croissance peuvent s'interconnecter et former un gel de particules. Un tel gel est un corps solide élastique, mais se différencie des solides ordinaires par un module d'élasticité très faible.
Homoagrégation et hétéroagrégation
Lorsque l'agrégation se produit dans une suspension composée de particules colloïdales monodispersées de types similaires, le processus est appelé homoagrégation (ou homocoagulation). Si l'agrégation se produit dans une suspension composée de particules colloïdales dissemblables, on parle d'hétéroagrégation (ou d'hétérocoagulation). Le processus d’hétéroagrégation le plus simple se produit lorsque deux types de particules colloïdales monodispersées A et B sont mélangés. Au cours des étapes préliminaires, les trois doublets suivants vont pouvoir se former[9] :
Alors que les deux premiers processus correspondent à une homoagrégation telle que dans des suspensions pures contenant soit des particules A soit des particules B, la dernière réaction correspond au processus d'hétéroagrégation proprement dit. Chacune de ces trois réactions est caractérisée par un coefficient d'agrégation kAA, kBB et kAB respectivement. Par exemple, lorsque les particules A et B portent respectivement une charge positive et une charge négative, les taux d’homoagrégation peuvent être lents, alors que le taux d’hétéroagrégation est rapide. Contrairement à l’homoagrégation, l’hétéroagrégation s’accélère à mesure que la concentration en sel diminue. Les clusters formés aux étapes ultérieures de ces processus d'hétéroagrégation sont encore plus ramifiés que ceux obtenus lors de la DLCA (d ≈ 1,4)[10].
Un cas particulier important de processus d’hétéroagrégation est celui du dépôt de particules sur un substrat[1]. Les étapes préliminaires du processus correspondent à la fixation de particules individuelles sur le substrat, ce dernier pouvant être vue comme une particule beaucoup plus grande. Les étapes ultérieures peuvent refléter le blocage du substrat par des interactions répulsives entre les particules, tandis que les interactions attractives peuvent conduire à une croissance multicouche. Ces phénomènes sont pertinents dans les cas d'entartrage des membranes ou des filtres.
Techniques expérimentales
De nombreuses techniques expérimentales ont été développées pour étudier l’agrégation de particules. Les plus fréquemment utilisées sont les techniques optiques à résolution temporelle, basées sur la transmittance ou la diffusion de la lumière[11].
Transmission de la lumière
Un spectrophotomètre ordinaire, fonctionnant dans la région du visible, permet d'étudier la variation de la lumière transmise à travers une suspension agrégée. Au fur et à mesure que l’agrégation progresse, le milieu devient de plus en plus trouble et son absorbance augmente. L'augmentation de l'absorbance peut être reliée au taux d'agrégation k et le rapport de stabilité peut être estimé à partir de ces mesures. Un avantage de cette technique est sa grande simplicité.
Diffusion de la lumière
Ces techniques sont basées sur la détection de la lumière diffusée par une suspension agrégée. La diffusion statique de la lumière conduit au changement de l'intensité de diffusion, tandis que la diffusion dynamique de la lumière conduit à la variation du rayon hydrodynamique apparent. Au cours des étapes préliminaires de l'agrégation, la variation de chacune de ces quantités est directement proportionnelle au taux d'agrégation k[12]. Durant les étapes ultérieurs, on peut obtenir des informations sur les clusters formés (par exemple, la dimension fractale)[8]. La diffusion de la lumière fonctionne bien pour une large gamme de tailles de particules. Il peut être nécessaire de prendre en compte plusieurs effets de diffusion, car la diffusion est plus importante avec des particules plus grosses, ainsi qu'avec des agrégats plus gros. De tels effets peuvent être négligés dans les suspensions faiblement troubles. Les processus d'agrégation dans les systèmes fortement diffusants ont été étudiés à l'aide des techniques de transmittance, de rétrodiffusion ou de spectroscopie par ondes diffusantes.
Comptage de particules individuelles
Cette technique offre une excellente résolution, grâce à laquelle des amas constitués de seulement quelques dizaines de particules peuvent être résolus individuellement[12]. La suspension agrégée est dirigée à travers un compteur de particules en forme de capillaire étroit et la taille de chaque agrégat est analysée par diffusion de la lumière. À partir de l’intensité diffusée, on peut déduire la taille de chaque agrégat et construire une distribution détaillée de la taille des agrégats. Si les suspensions contiennent de grandes quantités de sel, on peut également utiliser un compteur Coulter. Au fur et à mesure que le temps s'écoule, la distribution des tailles se déplace vers des agrégats plus grands, et il est possible de déduire le taux d'agrégation et le taux de rupture impliquant différents clusters à partir de ce déplacement. L’inconvénient de cette technique est que, les agrégats étant forcés à passer à travers un capillaire étroit sous un cisaillement élevé, ils ont tendance à se désagréger.
Techniques indirectes
Comme de nombreuses propriétés des suspensions colloïdales dépendent de l’état d’agrégation des particules en suspension, diverses techniques indirectes ont également été utilisées pour controler l’agrégation des particules. Bien qu’il puisse être difficile d’obtenir des informations quantitatives sur les taux d’agrégation ou les propriétés des clusters à partir de telles expériences, elles peuvent être très précieuses dans certaines applications pratiques. Parmi ces techniques, les tests de sédimentation sont les plus pertinents. Lorsqu'on inspecte une série de tubes à essai contenant des suspensions préparées à différentes concentrations de floculant, les suspensions stables restent souvent dispersées, tandis que les suspensions instables se déposent. Des instruments automatisés et basés sur la diffusion ou la transmittance de la lumière pour surveiller la sédimentation des suspensions ont été développés et peuvent être utilisés pour sonder l'agrégation des particules. Il faut cependant comprendre que ces techniques ne reflètent pas toujours correctement l’état d’agrégation réel d’une suspension. Par exemple, des particules primaires plus grosses peuvent se déposer même en l’absence d’agrégation. Ou encore, des agrégats ayant formé un gel colloïdal peuvent rester en suspension. D'autres techniques indirectes capables de surveiller l'état d'agrégation comprennent, par exemple, la filtration, la rhéologie, l'absorption des ultrasons ou les propriétés diélectriques[11].
Pertinence
L'agrégation de particules est un phénomène très répandu. Il se produit spontanément dans la nature, mais il est également exploré dans l'industrie manufacturière. En voici quelques exemples.
Formation du delta d'un fleuve
Lorsque l’eau d’une rivière transportant des particules de sédiments en suspension atteint l’eau salée, l’agrégation des particules peut être l’un des facteurs responsables de la formation du delta de la rivière. Les particules chargées sont stables dans l’eau douce des rivières, car ces dernières contiennent des niveaux en sel très faibles. Mais elles deviennent instables dans l’eau de mer. Dans ces milieux salins, les particules s'agrègent, les agrégats les plus gros se sédimentent et créent ainsi le delta du fleuve.
Fabrication du papier
Des agents de rétention sont ajoutés à la pâte pour accélérer la formation du papier. Ces agents sont des coagulants, qui accélèrent l'agrégation entre les fibres de cellulose et les autres particules. Des polyélectrolytes cationiques sont le plus fréquemment utilisés à cette fin.
Traitement des eaux
Le traitement des eaux municipales usées comprend normalement une phase d'élimination des fines particules solides. Cette séparation est réalisée par l'ajout d'un agent floculant ou coagulant, qui induit l'agrégation des solides en suspension. Les agrégats sont normalement séparés par sédimentation, ce qui donne des boues d'épuration. Les agents floculants couramment utilisés dans le traitement de l'eau comprennent des ions métalliques multivalents (par exemple, Fe3+ ou Al3+), des polyélectrolytes, ou les deux.
Fabrication du fromage
L’étape clé de la production du fromage est la séparation du lait en caillé solide et en lactosérum liquide. Cette séparation est obtenue en induisant les processus d'agrégation entre les micelles de caséine par acidification du lait ou par ajout de présure. L'acidification neutralise les groupes carboxylates sur les micelles et induit l'agrégation.
Voir également
- Aérosol
- Colloïde
- Théorie DLVO (stabilité des colloïdes)
- Double couche électrique
- Émulsion
- Floculation
- Gel (matériau)
- Nanoparticules
- Dépôt de particules
- Peptisation
- Décantation
- Équation de coagulation de Smoluchowski
- Procédé sol-gel
- Charge de surface
- Suspension (chimie)
Notes et références
Notes
Références
- ↑ a et b M. Elimelech, J. Gregory, X. Jia, R. Williams, Particle Deposition and Aggregation: Measurement, Modelling and Simulation, Butterworth-Heinemann, 1998.
- ↑ (en) Matthew Celnik, Tim Totton, Abhijeet Raj, Sebastian Mosbach, Richard West et Marcus Kraft, Modeling Soot Formation, NATO, (ISBN 978-92-837-0104-0, lire en ligne)
- ↑ a b et c W. B. Russel, D. A. Saville, W. R. Schowalter,Colloidal Dispersions,Cambridge University Press, 1989.
- ↑ D. F. Evans, H. Wennerstrom, The Colloidal Domain, John Wiley, 1999.
- ↑ (en) Tezak, Matijevic et Schuiz, « Coagulation of Hydrophobic Sols in Statu Nascendi. III. The Influence of the Ionic Size and Valency of the Counterion », The Journal of Physical Chemistry, vol. 59, no 8, , p. 769–773 (ISSN 0022-3654, DOI 10.1021/j150530a018)
- ↑ Gold Book IUPAC. Schulze–Hardy rule: "The generalization that the critical coagulation concentration for a typical lyophobic sol is extremely sensitive to the valence of the counter-ions (high valence gives a low critical coagulation concentration)". Source: PAC, 1972, 31, 577 (Manual of Symbols and Terminology for Physicochemical Quantities and Units, Appendix II: Definitions, Terminology and Symbols in Colloid and Surface Chemistry) on page 610.
- ↑ Gold Book IUPAC (1997). Schulze–Hardy rule. IUPAC Compendium of Chemical Terminology 2nd Edition (1997).
- ↑ a et b M. Y. Lin, H. M. Lindsay, D. A. Weitz et R. C. Ball, « Universality in colloid aggregation », Nature, vol. 339, no 6223, , p. 360–362 (DOI 10.1038/339360a0, Bibcode 1989Natur.339..360L, S2CID 4347275, lire en ligne)
- ↑ (en) James, Homola et Healy, « Heterocoagulation of amphoteric latex colloids », Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases, vol. 73, , p. 1436 (ISSN 0300-9599, DOI 10.1039/f19777301436)
- ↑ (en) Kim, Hauch, Berg et Martin, « Linear chains and chain-like fractals from electrostatic heteroaggregation », Journal of Colloid and Interface Science, vol. 260, no 1, , p. 149–159 (ISSN 0021-9797, PMID 12742045, DOI 10.1016/S0021-9797(03)00033-X, Bibcode 2003JCIS..260..149K)
- ↑ a et b Gregory, « Monitoring particle aggregation processes », Advances in Colloid and Interface Science, vol. 147-148, , p. 109–123 (ISSN 0001-8686, PMID 18930173, DOI 10.1016/j.cis.2008.09.003)
- ↑ a et b Holthoff, Schmitt, Fernández-Barbero et Borkovec, « Measurement of Absolute Coagulation Rate Constants for Colloidal Particles: Comparison of Single and Multiparticle Light Scattering Techniques », Journal of Colloid and Interface Science, vol. 192, no 2, , p. 463–470 (ISSN 0021-9797, PMID 9367570, DOI 10.1006/jcis.1997.5022, Bibcode 1997JCIS..192..463H)
 Portail de la physique
Portail de la physique



![{\displaystyle {\begin{aligned}\mathrm {A+A} &\longrightarrow \mathrm {A} _{2}\\[2pt]\mathrm {B+B} &\longrightarrow \mathrm {B} _{2}\\[2pt]\mathrm {A+B} &\longrightarrow \mathrm {AB} \end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/467890d7621153b5982eb4e809d65a18080fe34b)










