Réactif de Petasis
| Réactif de Petasis | |
 | |
| Structure du réactif de Petasis | |
| Identification | |
|---|---|
| Synonymes | diméthyltitanocène |
| No CAS | 1271-66-5 |
| No ECHA | 100.204.841 |
| No CE | 679-889-8 |
| PubChem | 92043608 |
| SMILES | [CH3-].[CH3-].[CH]1[CH][CH][CH][CH]1.[CH]1[CH][CH][CH][CH]1.[Ti+2] PubChem, vue 3D |
| InChI | Std. InChI : vue 3D InChI=1S/2C5H5.2CH3.Ti/c2*1-2-4-5-3-1;;;/h2*1-5H;2*1H3;/q;;2*-1;+2 Std. InChIKey : OXCNMHOFZZXZHZ-UHFFFAOYSA-N |
| Propriétés chimiques | |
| Formule | C12H16Ti |
| Masse molaire[1] | 208,122 ± 0,012 g/mol C 69,25 %, H 7,75 %, Ti 23 %, |
| Précautions | |
| SGH[2] | |
   Danger H225 : Liquide et vapeurs très inflammables H304 : Peut être mortel en cas d'ingestion et de pénétration dans les voies respiratoires H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux H332 : Nocif par inhalation H360 : Peut nuire à la fertilité ou au fœtus (indiquer l'effet s'il est connu)(indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H370 : Risque avéré d'effets graves pour les organes (ou indiquer tous les organes affectés, s'ils sont connus)(indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P233 : Maintenir le récipient fermé de manière étanche. P240 : Mise à la terre/liaison équipotentielle du récipient et du matériel de réception. P241 : Utiliser du matériel électrique/de ventilation/d’éclairage/…/antidéflagrant. P242 : Ne pas utiliser d'outils produisant des étincelles. P243 : Prendre des mesures de précaution contre les décharges électrostatiques. P260 : Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P264 : Se laver … soigneusement après manipulation. P270 : Ne pas manger, boire ou fumer en manipulant ce produit. P271 : Utiliser seulement en plein air ou dans un endroit bien ventilé. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P302+P352 : En cas de contact avec la peau : laver abondamment à l’eau et au savon. P303+P361+P353 : En cas de contact avec la peau (ou les cheveux) : enlever immédiatement les vêtements contaminés. Rincer la peau à l’eau/se doucher. P304+P340 : En cas d'inhalation : transporter la victime à l’extérieur et la maintenir au repos dans une position où elle peut confortablement respirer. | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le réactif de Petasis, ou diméthyltitanocène, est un composé organotitane de formule chimique Cp2Ti(CH3)2, où Cp représente un ligand cyclopentadiényle C5H5. Il a une efficacité voisine de celle du réactif de Tebbe Cp2Ti(CH2)(Cl)Al(CH3)2 dans l'oléfination des cétones, des aldéhydes, des esters et des lactones. Il est cependant plus facile à produire et plus stable, et permet d'introduire de plus gros résidus alors que seule la méthénylation est possible avec le réactif de Tebbe[3].
On l'obtient facilement à partir de dichlorure de titanocène Cp2TiCl2[4] par métathèse avec du chlorure de méthylmagnésium CH3MgCl ou du méthyllithium CH3Li[5] :
- Cp2TiCl2 + 2 CH3MgCl ⟶ Cp2Ti(CH3)2 + 2 MgCl2 ;
- Cp2TiCl2 + 2 CH3Li ⟶ Cp2Ti(CH3)2 + 2 LiCl.
Il est utilisé pour convertir des composés carbonylés en alcènes terminaux et peut agir sur une plus grande variété de composés carbonylés que la réaction de Wittig[6]. Il est très stable au contact de l'air et est généralement utilisé en solution dans le toluène ou dans le THF. Il forme probablement le même carbène de Schrock que le réactif de Tebbe comme intermédiaire réactionnel. La réaction se déroule cependant à une température plus élevée, de 60 à 80 °C, nécessaire pour séparer le méthyle du complexe de titane et former un complexe de carbène[7].
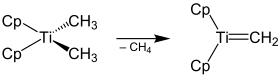
L'addition au carbonyle du carbène de Schrock obtenu par séparation du méthyle donne un cycle oxatitanecyclobutane intermédiaire qui libère l'alcène terminal par décyclisation[8]. La force motrice de la réaction est l'affinité du titane pour l'oxygène, comme celle du phosphore dans le cas des réactions de Wittig.

Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) « bis-(Cyclopentadienyl)dimethyltitanium », sur pubchem.ncbi.nlm.nih.gov, NIH > NLM > NCBI > PubChem (consulté le ).
- ↑ (de) Tanja Schirmeister, Carsten Schmuck et Peter Richard Wich, Beyer / Walter Organische Chemie, 25e éd., Hirzel, Stuttgart, 2016, p. 700-701. (ISBN 978-3-7776-1673-5)
- ↑ (en) Joseph F. Payack, David L. Hughes, Dongwei Cai, Ian F. Cottrell et Thomas R. Verhoeven, « Dimethyltitanocene », Organic Syntheses, vol. 79, , p. 19 (DOI 10.15227/orgsyn.079.0019, lire en ligne)
- ↑ (de) Karl Clauss et Herbert Bestian, « Über die Einwirkung von Wasserstoff auf einige metallorganische Verbindungen und Komplexe », Justus Liebigs Annalen der Chemie, vol. 654, no 1, , p. 8-19 (DOI 10.1002/jlac.19626540103, lire en ligne)
- ↑ (en) Richard C. Hartley, Jianfeng Li, Calver A. Main et Gordon J. McKiernan, « Titanium carbenoid reagents for converting carbonyl groups into alkenes », Tetrahedron, vol. 63, no 23, , p. 4825-4864 (DOI 10.1016/j.tet.2007.03.015, lire en ligne)
- ↑ (en) Jie Jack Li, Name reactions: A collection of detailed mechanisms and synthetic applications, 5e éd., Springer, 2014, p. 474-475. (ISBN 978-3-319-03979-4)
- ↑ (en) Eduardo Cesar Meurer, Leonardo Silva Santos, Ronaldo Aloise Pilli et Marcos N. Eberlin, « Probing the Mechanism of the Petasis Olefination Reaction by Atmospheric Pressure Chemical Ionization Mass and Tandem Mass Spectrometry », Organic Letters, vol. 5, no 9, , p. 1391-1394 (PMID 12713281, DOI 10.1021/ol027439b, lire en ligne)
v · m | |||||
|---|---|---|---|---|---|
| Ti(II) |
| ||||
| Ti(III) |
| ||||
| Ti(IV) |
| ||||
 Portail de la chimie
Portail de la chimie









