テトラカルボニル鉄(-II)酸ナトリウム
| テトラカルボニル鉄(-II)酸ナトリウム | |
|---|---|
 | |
disodium tetracarbonylferrate(-II) | |
別称 テトラカルボニル鉄酸ナトリウム コールマン試薬 | |
| 識別情報 | |
| CAS登録番号 | 14878-31-0 |
| 特性 | |
| 化学式 | C4FeNa2O4 |
| モル質量 | 213.87 |
| 外観 | 無色固体 |
| 密度 | 2.16 g/cm3, 固体 |
| 水への溶解度 | 分解 |
| 他の溶媒への溶解度 | テトラヒドロフラン、ジメチルホルムアミド、ジオキサンに可溶 |
| 構造 | |
| 結晶構造 | 歪んだ四面体形 |
| 配位構造 | 四面体形 |
| 危険性 | |
| 主な危険性 | 自然発火 |
| 関連する物質 | |
| 関連物質 | ペンタカルボニル鉄 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
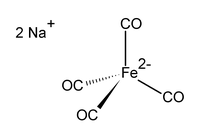
テトラカルボニル鉄(-II)酸ナトリウム(テトラカルボニルてつ マイナスに さんナトリウム、英: disodium tetracarbonylferrate(-II))は、化学式が Na2[Fe(CO)4] と表される錯体である。酸素に敏感な無色の固体で、主にアルデヒドの合成[1]のために有機合成において用いられる[2]。これは一般に、コールマン試薬として知られるジオキサンとの溶媒和物の形で使われる[3]。ジオキサン中でナトリウムイオンはジオキサンと複合体を形成している。テトラカルボニル鉄(-II)酸ジアニオンは四面体形である[4]。
合成
この化合物は1970年に Cooke によって報告された[5]。現在はナトリウムナフタレニドによってテトラヒドロフラン溶液中のペンタカルボニル鉄を還元することによって合成されている。この合成効率はペンタカルボニル鉄の純度に依存する[2]。
反応
この試薬は、もともと一級アルキル臭化物 RBr を対応するアルデヒドに2ステップで変換するワンポット合成法について記述された[5]。
この後この溶液は PPh3 および酢酸で順次処理され、アルデヒド RCHO を与える。
テトラカルボニル鉄(-II)酸ナトリウムは酸塩化物をアルデヒドに変換するために使用できる。Cooke の発見においては、鉄アシル錯体がプロトノリシスを起こし、アルデヒドを与える。
テトラカルボニル鉄(-II)酸ナトリウムはハロゲン化アルキル RX と反応してアルキル錯体を生成する。
このような鉄アルキル錯体は、対応するカルボン酸および酸ハロゲン化物に変換できる。
これらの手法の魅力の1つは、副生物が鉄ベースであるために手順が比較的“グリーン”であるという事実と、鉄カルボニルの低コストさにある。
出典
- ^ Pike, Robert D., (2001). Disodium Tetracarbonylferrate (II-). Encyclopedia of Reagents for Organic Synthesis.
- ^ a b Strong, H.; Krusic, P. J.; San Filippo, J. (1990). Robert J. Angelici. ed. “Sodium Carbonyl Ferrate, Na2Fe(CO)], Na2[Fe2(CO)8], and Na2[Fe3(CO)11]. Bis[μ-Nitrido-Bis(triphenylphosphorus)(1+] Undecarcarbonyltriferrate(2-), [(Ph3P)2N]2[Fe3(CO)11]”. Inorganic Syntheses (New York: J. Wiley & Sons) 28: 203–207. doi:10.1002/9780470132593.ch52. ISBN 0-471-52619-3.
- ^ Miessler, G. L., Tarr, D. A. (2004). Inorganic chemistry. Upper Saddle River,New Jersey: Pearson Publication.
- ^ H. B. Chin, R. Bau (1976). “The Crystal Structure of Disodium Tetracarbonylferrate. Distortion of the Tetracarbonylferrate(2-) Anion in the Solid State”. J. Am. Chem. Soc. 98: 2434–2439. doi:10.1021/ja00425a009.
- ^ a b M. P. Cooke (1970). “Facile conversion of alkyl bromides into aldehydes using sodium tetracarbonylferrate(-II)”. J. Am. Chem. Soc. 92 (20): 6080–6082. doi:10.1021/ja00723a056.
参考文献
- J. P. Collman (1975). “Disodium Tetracarbonylferrate, a Transition Metal Analog of a Grignard reagent”. Accounts of Chemical Research 8: 342–347. doi:10.1021/ar50094a004.
- C. Ungurenasu, C. Cotzur (1982). “Disodium Tetracarbonylferrate: A Reagent for Acid Functionalization of Halogenated Polymers”. Journal Polymer Bulletin 6: 299–303. doi:10.1007/BF00255401.
- V. W. Hieber, G. Braun (1959). Zeitschrift für Naturforschung 146: 132.
![{\displaystyle {\ce {Fe(CO)5\ + 2Na -> Na2[Fe(CO)4]\ + CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb632b1b835298d69c99ff24686ba475308c4ee1)
![{\displaystyle {\ce {Na2[Fe(CO)4]\ + RBr -> Na[RFe(CO)4]\ + NaBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcb24af7370341275cc2c9c540d02a0383d4b552)
![{\displaystyle {\ce {Na2[Fe(CO)4]\ + RCOCl -> Na[RC(O)Fe(CO)4]\ + NaCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb3588e17781bab50e091effd526adadd069e4ac)
![{\displaystyle {\ce {Na[RC(O)Fe(CO)4]\ + HCl -> RCHO\ + Fe(CO)4\ + NaCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6516d6cde080cf54f3cbdb6f270948072b359b5)
![{\displaystyle {\ce {Na2[Fe(CO)4]\ + RX -> Na[RFe(CO)4]\ + NaX}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e9e93fd6d0d16b3a1fa945b9158b54f07a7d3e17)
![{\displaystyle {\ce {Na[RFe(CO)4]\ + O2, H^+ -> RCO2H\ + Fe...}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e687e2edd345b45c7402bd6cb75cc66b3668931)
![{\displaystyle {\ce {Na[RFe(CO)4]\ + X2 -> RC(O)X\ + FeX2\ + 3CO\ + NaCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/679e561362fdc1adce9aaf726e6845ed32c5190b)








