Nucleofiele acylsubstitutie
De nucleofiele acylsubstitutie is een type substitutiereactie waarbij een nucleofiel bindt aan een carbonyl-koolstofatoom en een leaving group aan een acylverbinding verdrijft.
Reactiemechanisme
De reactie van een nucleofiel met de polaire carbonylgroep van bijvoorbeeld een aldehyde of keton resulteert in een nucleofiele additie met een tetraëdrisch alkoxide als primair reactieproduct. Bij acylverbindingen echter is het carbonyl-koolstofatoom gebonden aan een substituent dat kan fungeren als leaving group (L). Door de nucleofiele aanval op de carbonylgroep ontstaat een tijdelijk tetraëdrisch intermediair, waarbij zuurstof een negatieve lading verkrijgt (een zogenaamd alkoxide). De carbonylgroep, die een thermodynamisch en elektronisch gunstig functionele groep is, zal zich hervormen. Hierbij kunnen twee dingen plaatsgrijpen: het nucleofiel wordt weer afgesplitst of de leaving group wordt afgesplitst. In het geval van koolstofnucleofielen (carbanionen), zal steeds de leaving group afgesplitst worden, omdat een koolstof-koolstofbinding zeer sterk is. In het geval van zuurstof- of stikstofnucleofielen treedt er doorgaans een evenwicht op tussen het oorspronkelijke en het substitutieproduct, en kan het evenwicht naar het eindproduct worden verlegd door bijvoorbeeld een overmaat van het nucleofiel te gebruiken.
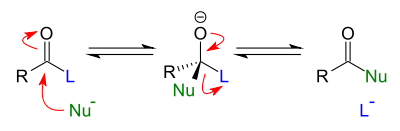
Deze acylsubstitutie is in wezen eigenlijk een tweestapsmechanisme: een nucleofiele additie, gevolgd door een eliminatie. Beide reactiestappen zijn reversibel, behalve wanneer met koolstofnucleofielen wordt gewerkt. De additie (eerste stap) is meestal de snelheidsbepalende stap. Alle reacties van carbonzuren, carbonzure esters, amiden, peptiden en zuurhalogeniden zijn variaties op dit thema. Bij de eerste vier stofgroepen wordt vaak een (Lewis-)zure katalysator toegevoegd, de vijfde groep reageert onder invloed van biokatalysatoren: enzymen. Halogenide-ionen zijn goede leaving groupen, zodat deze verbindingen geen katalysator nodig hebben om de reactie uit te kunnen voeren. De werking van de katalysator kan op verschillende punten in het reactiemechanisme aangrijpen:
- de katalysator bindt in het eerste deel van de reactie aan de zuurstof van de carbonylgroep, waardoor de reactie op het koolstofatoom (lading wegtrekken) makkelijker verloopt.
- de katalysator bindt aan het atoom van de leaving group waarmee deze aan het koolstofatoom gebonden is, waardoor de leaving group makkelijker (ongeladen) vertrekt
Enzymen verzorgen meestal beide aspecten, hoewel vanuit verschillende aminozuurresiduen rond het reactieve centrum van het enzym.
Voorbeelden
| Uitgangsstof | Leaving group | Nucleofiel | Reactieproduct | Katalysator |
|---|---|---|---|---|
| Carbonzuur | OH− | Alkoxide | Ester | OH− |
| Carbonzuur | H2O | Alkanol | Ester | H+ |
| Carbonzuur | H2O | Amine | Amide | H+ |
| Zuurchloride | Cl− | Alcohol | Ester | geen |
| Ester | Alkanol | H2O | Carbonzuur | H+ |
| Ester | Alkanol | OH− | Carboxylaat | geen |
Toepassingen
Tal van condensatiereacties maken gebruik van dit principe. Carbonzuren reageren zo met chloridedonoren (zoals thionylchloride, fosfortrichloride of oxalylchloride) tot zuurchloriden, met alcoholen tot esters (verestering), met amines tot amiden en met carbonzuren via een autocondensatie tot carbonzuuranhydriden.
Esters reageren met Grignard-reagentia in een nucleofiele acylsubstitutie en een nucleofiele additie tot tertiaire alcoholen. Esters kunnen ook met enolaten reageren: zo reageert ethylacetaat met aceton tot acetylaceton.
De Baker-Venkataraman-omlegging is een nucleofiele acylsubstitutie die gebruikt wordt ter synthese van flavonen. Bij de Weinreb-ketonsynthese worden ketonen bereid uit carbonzuur-precursors.
De reductie van esters met lithiumaluminiumhydride verloopt door middel van een nucleofiele acylsubstitutie. Daarna grijpt nog een nucleofiele additie plaats.








