Sikkel van Koller



De sikkel van Koller of sikkel van Rauber komt bij de gastrulatie van vogels voor. Het is een lokale verdikking van cellen aan de achterste rand van de bovenste laag van de area pellucida dat de epiblast wordt genoemd. De sikkel van Koller is cruciaal voor de ontwikkeling van vogelembryo's, vanwege zijn cruciale rol bij het induceren van de differentiatie van verschillende lichaamsdelen van vogels. De sikkel van Koller induceert door de uitscheiding van FGF (fibroblastgroeifactor) en het Nodal-gen de primitieve streep en de knoop van Hensen, die belangrijke componenten zijn tijdens de gastrulatie bij vogels. De gastrulatie bij vogels is een proces waarbij zich ontwikkelende cellen in een vogelembryo ten opzichte van elkaar bewegen om de drie kiembladen te vormen (endoderm, mesoderm en ectoderm).
De verdikking van de epiblast in de sikkel van Koller fungeert als een rand die de cellagen scheidt van de posterior zijde van blastodermen van hypoblast en het area opaca-endoderm. Het blastoderm bestaat uit een enkele laag cellen en de hypoblast- en area opaca-endodermcellen liggen direct onder het blastoderm. De sikkel van Koller ontstaat vanuit het middelpunt, tussen de hypoblastcellen en het area opaca endoderm. De laag cellen, die vooraan uit de sikkel van Koller groeit, vormt samen met de primaire hypoblast de secundaire hypoblast (ook wel de endoblast genoemd).[2] De voorste cellen van de sikkel van Koller vormen de knoop van Hensen en zijn notochord-afgeleiden. De achterste cellen vormen het posterior gebied van de primitieve streep.
Celbewegingen
Cellen die over de sikkel van Koller liggen in het posterior uiteinde van het kippenembryo bewegen naar de middellijn, ontmoeten die en veranderen van richting naar het midden van de epiblast. Cellen uit de laterale posterior marginale zone vervangen de cellen die de sikkel van Koller verlieten door elkaar te ontmoeten in het midden van dit gebied, van richting te veranderen en naar voren uit te breiden.[3][4] Terwijl deze cellen bewegen en zich concentreren aan het posterior uiteinde van het embryo, ondergaat de primitieve streep een overgang van een enkele naar meerlaagse epitheellaag, waardoor het een macroscopisch zichtbare structuur wordt.[3] Verschillende mechanismen, waaronder actieve celproliferatie, georiënteerde celdeling, cel-cel-intercalatie en chemotactische celbeweging, zijn voorgesteld om de aard van de cellulaire bewegingen te verklaren die nodig zijn om de primitieve streep te vormen.[5][3]
Geschiedenis
De sikkel van Koller werd oorspronkelijk beschreven door August Rauber in 1876. Daarom wordt de sikkel van Koller ook wel de sikkel van Rauber genoemd.[6]
In 1926 bestudeerde Ludwig Graper voor het eerst de betrokkenheid van de sikkel van Koller bij de vorming van de primitieve streep. De celbewegingen deden hem denken aan een dans genaamd de polonaise, waarbij dansers zich in evenwijdige lijnen bewegen en waarbij ze zich van de achterkant van de groep naar het midden bewegen. Pas in 2007 werd het mechanisme voor deze bewegingen ontdekt door Voiculescu en zijn medewerkers. Ze stelden vast dat cellen naar het centrum van de epiblast bewegen na de activering van het Wnt-planaire celpolariteitsreactiepad door fibroblastgroeifactoren gemaakt door de hypoblast.[7]
Expressie van genen
De sikkel van Koller is een van de twee regio's (de andere is het caudale grensgebied van de area opaca) waar genen die belangrijk zijn voor de gastrulatie, zijn gelokaliseerd. Het NODAL-gen komt bijvoorbeeld alleen tot expressie in de sikkel van Koller.[8]
Hoewel er nog geen enkel gen geïsoleerd is voor het ontstaan van de sikkel van Koller, zijn er aanwijzingen dat het homeobox-gen 'Hex' de ontwikkeling van de sikkel van Koller beïnvloedt. Het transcript cHex, dat een product is van Hex, is vastgesteld in de sikkel van Koller tijdens de embryogenese van kippen. cHex is ook betrokken bij de vorming van de hypoblast, het endoderm in een voorste boog die het cardiogene gebied overlapt, het faryngeale endoderm onmiddellijk grenzend aan het zich vormende myocardium, in het endocardium, en in de lever- en de schildklierprimordia.[9]
Het is ook mogelijk dat het homeobox-gen goosecoid (homeobox protein goosecoid) betrokken is bij de vorming van de sikkel van Koller, aangezien de cellen van de sikkel van Koller de eersten zijn die het goosecoid-transcript tot expressie brengen. Over het algemeen wordt aangenomen dat het goosecoid-gen betrokken is bij de ontwikkeling van de kippenorganisator tijdens gastrulatie.[10]
Huidig onderzoek
Er is nog veel onbekend over de sikkel van Koller. Door een fragment van de kwartelsikkel van Koller in een kippenblastoderm te implanteren, konden Drs. Callebaut en Van Nueten de vorming van een normale secundaire primitieve streep, mesoderm en definitief endoderm observeren. Dit bracht hen tot de conclusie dat de sikkel van Koller de vroege vogelrepresentatie is van de organisator, en dat er homologie bestaat tussen de sikkel van Koller bij vogels en de blastoporus bij amfibieën.[11] Drs. Callebaut en Van Nueten optimaliseerden ook een methode voor de bereiding van niet-geïncubeerde vogeleieren, en toonden hieruit aan dat embryonale regulatie het gevolg is van de ruimtelijke verdeling van weefsel van de sikkel van Kollers..[12] Daarnaast konden Drs. Callebaut en Van Nueten vaststellen dat de differentiatie van de cellen van de sikkel van Koller tot sikkel-secundaire hypoblast onomkeerbaar is, en dat de sikkel-secundaire hypoblast vroege neurulatie induceert; ze deden dit door weefsel van de sikkel van Koller in verschillende delen van niet-geïncubeerde kippenblastodermen te implanteren en de effecten te observeren..[13]
Afbeeldingen
-
 Wnt 8c-expressie, gevolgd met in-situhybridisatie tijdens de vorming van de sikkel van Koller en de primitieve streep in het embryo van de kip. In opeenvolgende stadia worden RNA’s van Wnt8c (A, D, G) en Chordin (B, E, H) tot expressie gebracht. Wnt zien we eerst in de Area Opaca (AO) vervolgens onderaan en daarna langs de primitieve streep. In (C, F, I) is de groei waar te nemen door de (kleine) snelheidspijlen te volgen. Zwarte pijlen geven het voorste uiteinde van de primitieve streep aan.
Wnt 8c-expressie, gevolgd met in-situhybridisatie tijdens de vorming van de sikkel van Koller en de primitieve streep in het embryo van de kip. In opeenvolgende stadia worden RNA’s van Wnt8c (A, D, G) en Chordin (B, E, H) tot expressie gebracht. Wnt zien we eerst in de Area Opaca (AO) vervolgens onderaan en daarna langs de primitieve streep. In (C, F, I) is de groei waar te nemen door de (kleine) snelheidspijlen te volgen. Zwarte pijlen geven het voorste uiteinde van de primitieve streep aan. -
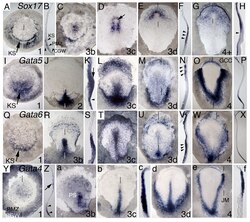 Moleculaire markers onthullen subpopulaties van definitief endoderm. KS=sikkel van Koller
Moleculaire markers onthullen subpopulaties van definitief endoderm. KS=sikkel van Koller -
 Schematische tekening van de definitieve oorsprong van het endoderm. KS=sikkel van Koller
Schematische tekening van de definitieve oorsprong van het endoderm. KS=sikkel van Koller
Externe links
- Sikkel van Koller op Developmental Biology, Eleventh Edition
- Induction of primitive streak and Hensen's node by the posterior marginal zone in the early chick embryo.
- ↑ Vasiev, Bakhtier, Balter, Ariel, Chaplain, Mark, Glazier, James A., Weijer, Cornelis J. (2010). Modeling Gastrulation in the Chick Embryo: Formation of the Primitive Streak. PLOS ONE 5 (5): e10571. PMID 20485500. PMC 2868022. DOI: 10.1371/journal.pone.0010571.
- ↑ Barresi, Michael, Gilbert, Scott (July 2019). Developmental Biology, 12th. Oxford University Press. ISBN 978-1605358222.
- ↑ a b c Chuai M, Weijer CJ (2008). The mechanisms underlying primitive streak formation in the chick embryo. Curr Top Dev Biol Current Topics in Developmental Biology 81: 135–56. PMID 18023726. DOI: 10.1016/S0070-2153(07)81004-0.
- ↑ Hatada Y, Stern CD (1994). A fate map of the epiblast of the early chick embryo. Development 120 (10): 2879–89. PMID 7607078. DOI: 10.1242/dev.120.10.2879.
- ↑ Mikawa, Takashi, Poh, Alisa M., Kelly, Kristine A., Ishii, Yasuo, Reese, David E. (2004). Induction and patterning of the primitive streak an organizing centre of gastrulation in the amniote. Developmental Dynamics 229 (3): 422–432. PMID 14991697. DOI: 10.1002/dvdy.10458.
- ↑ Bellairs, Ruth (2005). Atlas of Chick Development, 2. Academic Press, p. 19. ISBN 9780080454757.
- ↑ Gilbert, Scott F. (2013). Developmental Biology, 10th. Sinauer Associates, Sunderland, "Early Development in Birds", 286–97. ISBN 978-1-60535-173-5.
- ↑ Schnell, Santiago (2007). Multiscale Modeling of Developmental Systems. Academic Press, pp. 167. ISBN 9780080556536.
- ↑ Yatskievych, Tatiana A, Pascoe, Sharon, Antin, Parker B (1999). Expression of the homeobox gene Hex during early stages of chick embryo development. Mechanisms of Development 80 (1): 107–9. PMID 10096068. DOI: 10.1016/S0925-4773(98)00204-4.
- ↑ Izpisúa-Belmonte, Juan Carlos, De Robertis, Eddy M., Storey, Kate G., Stern, Claudio D. (1993). The homeobox gene goosecoid and the origin of organizer cells in the early chick blastoderm. Cell 74 (4): 645–59. PMID 7916659. DOI: 10.1016/0092-8674(93)90512-O.
- ↑ Callebaut, M, Van Nueten, E (1994). Rauber's (Koller's) sickle: The early gastrulation organizer of the avian blastoderm. European Journal of Morphology 32 (1): 35–48. PMID 8086267.
- ↑ Callebaut, Marc, Van Nueten, Emmy, Harrisson, Fernand, Bortier, Hilde (2007). Mosaic versus regulation development in avian blastoderms depends on the spatial distribution of Rauber's sickle material. Journal of Morphology 268 (7): 614–23. PMID 17450588. DOI: 10.1002/jmor.10528.
- ↑ Callebaut, M, Van Nueten, E, Bortier, H, Harrisson, E (2002). Avian sickle endoblast induces gastrulation or neurulation in the isolated area centralis or isolated anti-sickle region respectively. European Journal of Morphology 40 (1): 1–13. PMID 12959343. DOI: 10.1076/ejom.40.1.1.13955.













