Цианид ртути(II)
| Цианид ртути(II) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Цианид ртути(II) | ||
| Традиционные названия | Цианид ртути | ||
| Хим. формула | Hg(CN)2 | ||
| Рац. формула | Hg(CN)2 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 252,63 г/моль | ||
| Плотность | 3,4[1] | ||
| Термические свойства | |||
| Температура | |||
| • разложения | 320 °C | ||
| Классификация | |||
| Рег. номер CAS | 592-04-1 | ||
| PubChem | 11591 и 101667997 | ||
| Рег. номер EINECS | 209-741-6 | ||
| SMILES | C(#N)[Hg]C#N | ||
| InChI | InChI=1S/2CN.Hg/c2*1-2; FQGYCXFLEQVDJQ-UHFFFAOYSA-N | ||
| ChEBI | 36573 | ||
| Номер ООН | 1636 | ||
| ChemSpider | 11103 | ||
| Безопасность | |||
| Предельная концентрация | <0.0001 мг/м3 | ||
| ЛД50 | 26 мг/кг (мыши, перорально) | ||
| Токсичность | высокотоксичен, обладает нейротоксичностью, метаболический яд | ||
| Пиктограммы ECB |    | ||
| NFPA 704 |  0 4 0 POI | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Циани́д рту́ти(II) — неорганическое соединение, ртутная соль синильной кислоты. Химическая формула — Hg(CN)2. Белое или бесцветное кристаллическое соединение без запаха, растворимое в воде, очень ядовитое.
Физические свойства
Элементарный состав: Hg 79,40 %, C 9,51 %, N 11,09 %. Молекула цианида ртути практически линейная, угол С—Hg—C составляет 175 °. Связи Hg—C в соединении ковалентные — вещество не диссоциирует в воде. В нормальных условиях образует бесцветные тетраэдрические кристаллы.
Вещество растворимо в воде (11,3 г/100 г воды при 25 °C[2]), спирте, эфире.
Получение
Известны следующие способы получения соединения:
- Взаимодействие оксида ртути с синильной кислотой:
- Взаимодействие солей ртути с синильной кислотой или растворами цианидов:
- Реакция сульфата ртути(II) c гексацианоферратом(II) калия:
Химические свойства
На воздухе постепенно окисляется и темнеет.
С растворами цианидов образует комплексы:
При действии иодида калия разрушается, образуя
тетраиодомеркурат(II) калия:
При нагревании выше 320 °C разлагается с образованием металлической ртути и дициана:
При нагревании с хлоридом ртути(II) также образует дициан:
Реакция с иодом приводит к образованию иодциана:
Применение
Бесцветные просвечивающие кристаллы, легко растворимые в воде (1 : 13 в холодной и 1 : 3 в кипящей), растворимые в спирте (1 : 12). Содержат 79% ртути. Применяли для лечения больных сифилисом, а также как дезинфицирующее средство.
При лечении сифилиса вводили внутримышечно или внутривенно. В мышцы вводился 1 мл 2% раствора один раз в 2 дня. Курс лечения состоит из 20 инъекций. В вену вводился 1% раствор, начиная с 0,5 мл, затем дозу увеличивают до 0,75 и 1 мл. Вводят ежедневно в течение 30—40 дней.
Внутривенное введение было показано преимущественно при необходимости оказать быстрое воздействие на процесс (при сифилисе нервной системы, полости рта, гортани и др.).
Высшие дозы для взрослых в мышцы: разовая и суточная — 0,02 г; в вену — 0,01 г.
Так же использовался как дезинфицирующее средство для промываний и спринцеваний при воспалительных процессах растворами концентрацией 1 : 1000, 1 : 2000.
Сохраняют под замком в стеклянных банках с притертыми пробками.
В настоящее время не используется из-за чрезвычайной токсичности.
Токсичность

Цианид ртути чрезвычайно токсичен, обладает нейротоксичным воздействием, вызывает сильнейшее поражение ЦНС. Картина отравления сходна с отравлением металлической ртутью.
Примечания
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 114. — ISBN 5-7107-8085-5.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 621. — ISBN 5-7107-8085-5.
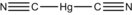




![{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+3HgSO_{4}=3Hg(CN)_{2}+2K_{2}SO_{4}+FeSO_{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29c4301deb928c9cba84712d0b5be28a4a7dee55)
![{\displaystyle {\mathsf {Hg(CN)_{2}+2CN^{-}=[Hg(CN)_{4}]^{2-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9d963faf3a639549560b6e9e1316367002f9f0b)
![{\displaystyle {\mathsf {Hg(CN)_{2}+4KI=K_{2}[HgI_{4}]+2KCN}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b083f10612783f29ec0b249e9b461c042983d282)












