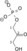| Fosfopiruvat hidrataza |
|---|
| Identifikatori |
|---|
| EC broj | 4.2.1.11 |
|---|
| CAS broj | 9014-08-8 |
|---|
| Baze podataka |
|---|
| IntEnz | IntEnz pregled |
|---|
| BRENDA | BRENDA pristup |
|---|
| ExPASy | NiceZyme pregled |
|---|
| KEGG | KEGG pristup |
|---|
| MetaCyc | metabolički put |
|---|
| PRIAM | profil |
|---|
| Strukture PBP | RCSB PDB PDBe PDBj PDBsum |
|---|
| Ontologija gena | AmiGO / EGO |
|---|
| Pretraga |
|---|
| PMC | članci |
|---|
| PubMed | članci |
|---|
| NCBI | proteini |
|---|
|
U enzimologiji, fosfopiruvat hidrataza (EC 4.2.1.11) je enzim koji katalizuje hemijsku reakciju[1][2][3]
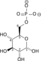
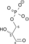
- 2-fosfo-D-glicerat
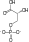
 fosfoenolpiruvat + H2O
fosfoenolpiruvat + H2O
Ovaj enzim ima jedan supstrat, 2-fosfo-D-glicerat, i dva produkta, fosfoenolpiruvat i H2O.
Ovaj enzim pripada familiji lijaza, specifično hidrolijaza, koji presecaju ugljenik-kiseonik veze. Sistematsko ime ove klase enzima je 2-fosfo-D-glicerat hidrolijaza (fosfoenolpiruvat formirajuća). Druga imena u čestoj upotrebi su: enolaza, 2-fosfoglicerat dehidrataza, 14-3-2-protein, specifična enolaza nervnog sistema, fosfoenolpiruvat hidrataza, 2-fosfoglicerat dehidrataza, 2-fosfoglicerinska dehidrataza, 2-fosfoglicerat enolaza i gama-enolaza. Ovaj enzim učestvuje u glikolizi/glukoneogenezi. Jedan od poznatih inhibitora je fosfonoacetohidroksamat. Ljudski gen za ovaj enzim je ENO2.
Strukturne studije
Neke od rešenih struktura enzima ove klase su: 1E9I, 1EBG, 1EBH, 1ELS, 1IYX, 1L8P, 1NEL, 1OEP, 1ONE, 1P43, 1P48, 1PDY, 1PDZ, 1TE6, 1W6T, 2AKM, 2AKZ, 2AL1, 2AL2, 2FYM, 2ONE, 2PA6, 3ENL, 4ENL, 5ENL, 6ENL, and 7ENL.
Reference
- ^ Pancholi V (2001). „Multifunctional α-enolase: its role in diseases”. Cell Mol Life Sci. 58 (7): 902—20. PMID 11497239. doi:10.1007/PL00000910. Архивирано из оригинала 05. 01. 2013. г. Приступљено 17. 12. 2012.
- ^ Hoorn RK, Flickweert JP, Staal GE (1974). „Purification and properties of enolase of human erythroctyes”. Int J Biochem. 5 (11–12): 845—52. doi:10.1016/0020-711X(74)90119-0.
- ^ Lohman K & Meyerhof O (1934) Über die enzymatische umwandlung von phosphoglyzerinsäure in brenztraubensäure und phosphorsäure (Enzymatic transformation of phosphoglyceric acid into pyruvic and phosphoric acid). Biochem Z 273, 60–72.
Literatura
- Holt A, Wold F (1961). „The isolation and characterization of rabbit muscle enolase”. J. Biol. Chem. 236: 3227—31. PMID 13908561.
- Boyer, P.D., Lardy, H. and Myrback, K. (Eds.), The Enzymes, 2nd ed., vol. 5, Academic Press, New York, 1961, pp. 471–494.
- Westhead EW, McLain G (1964). „A Purification of Brewers' and Bakers' Yeast Enolase Yielding a Single Active Component”. J. Biol. Chem. 239: 2464—8. PMID 14235523.
- Nicholas C. Price; Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third изд.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 изд.). Wiley-Interscience. ISBN 0471205036.
- Branden C; Tooze J. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 изд.). Wiley Classics Library. ISBN 0471303097.
- William P. Jencks (1987). Catalysis in Chemistry and Enzymology. Dover Publications. ISBN 0486654605.
Spoljašnje veze
|
| mt, a/u/y/n/h,r/g/c/p/i,f/s/l/o,m,e,t | au/u/n/h,rgcp/i,f/s/l/o,m, epon | med(A16,C10),med(a/ur/y/n/h,r/g/c/p/i,f/s/o,e,t) |
|
|
|
|---|
| Glikoliza | |
|---|
| Glukoneogeneza | |
|---|
| Regulatorni | |
|---|
|
|---|
| 4.2.1: Hidro-lijaze | |
|---|
| 4.2.2: Delovanje na polisaharide | |
|---|
| 4.2.3: Delovanje na fosfate | |
|---|
| 4.2.99: Druge | |
|---|
|
|---|
| Teme | |
|---|
| Tipovi | |
|---|
- B enzm: 1.1/2/3/4/5/6/7/8/10/11/13/14/15-18, 2.1/2/3/4/5/6/7/8, 2.7.10, 2.7.11-12, 3.1/2/3/4/5/6/7, 3.1.3.48, 3.4.21/22/23/24, 4.1/2/3/4/5/6, 5.1/2/3/4/99, 6.1-3/4/5-6
|
Portali: Molekularna i ćelijska biologija
Molekularna i ćelijska biologija Hemija
Hemija